🧪 Farma/Salud - Sector Farmacéutico
🔬1. Introducción - Sector Farmacéutico 🧬
El sector farmacéutico se erige como un pilar fundamental de la economía global y la salud pública, atrayendo el interés de inversores por su naturaleza distintiva y su potencial de crecimiento a largo plazo.
1.1. Historia y Evolución de la Industria Farmacéutica 📜
La trayectoria de la industria farmacéutica es un relato de transformación, desde sus orígenes en la botánica medicinal hasta la sofisticada biotecnología moderna. El siglo XIX marcó un punto de inflexión con el aislamiento de principios activos de plantas, sentando las bases para la farmacología moderna. El siglo XX fue testigo del surgimiento de los "medicamentos milagro", como los antibióticos y las vacunas, que revolucionaron la medicina y la esperanza de vida. Este período consolidó la investigación y desarrollo (I+D) como el núcleo de la industria, un pilar que ha continuado creciendo en complejidad y envergadura. La globalización y la creciente exigencia regulatoria han moldeado aún más el sector, transformándolo en una de las industrias más reguladas y con mayor intensidad de capital.
La evolución de la industria farmacéutica revela un cambio fundamental en su modelo de negocio. Históricamente, la rentabilidad se generaba a través de la fabricación a gran escala de compuestos químicos relativamente sencillos. Sin embargo, con el avance científico y la intensificación de las regulaciones, el valor se ha desplazado hacia la invención y la protección rigurosa de la propiedad intelectual. Esta transformación implica que el riesgo y la recompensa se concentran cada vez más en las fases iniciales del desarrollo de fármacos. En consecuencia, la inversión en I+D se ha convertido en una apuesta de alto riesgo y alta recompensa, y la valoración de las empresas depende en gran medida de la calidad de su "pipeline" de productos en desarrollo y de su capacidad de innovación, más allá de su mera capacidad de producción.
1.2. Importancia Económica y Social del Sector 🌍
El sector farmacéutico desempeña un papel crucial en la salud pública, mejorando la calidad de vida y prolongando la existencia humana a través del desarrollo de tratamientos y curas innovadoras. Su contribución económica es igualmente significativa, aportando una parte sustancial al Producto Interno Bruto (PIB) global y generando empleo en áreas de alta especialización como la I+D, la fabricación y la distribución.
Una característica distintiva de esta industria es su resiliencia. A menudo, el sector farmacéutico se ve menos afectado por los ciclos económicos recesivos en comparación con otras industrias. Esto se debe a la demanda inelástica de medicamentos; las enfermedades persisten y la necesidad de tratamientos, especialmente para condiciones crónicas o potencialmente mortales, se mantiene incluso durante periodos de contracción económica. Esta estabilidad en la demanda proporciona una base de ingresos más sólida para las empresas farmacéuticas, lo que puede actuar como un amortiguador de la volatilidad en una cartera de inversión global. Sin embargo, es importante reconocer que esta resiliencia no exime al sector de otros riesgos inherentes, como los desafíos regulatorios o la expiración de patentes.
1.3. Características Clave que lo Hacen Atractivo para la Inversión ✨
El atractivo de la inversión en el sector farmacéutico se sustenta en varias características fundamentales:
-
Potencial de Crecimiento a Largo Plazo: La demanda de medicamentos está en constante aumento, impulsada por el envejecimiento de la población mundial, el incremento de enfermedades crónicas y los continuos avances tecnológicos en la medicina.
-
Altos Márgenes de Beneficio: Los medicamentos innovadores, protegidos por patentes, suelen generar márgenes de beneficio sustanciales, lo que recompensa la inversión en I+D.
-
Barreras de Entrada Elevadas: La complejidad y el costo de la I+D, junto con los rigurosos requisitos regulatorios y la necesidad de una profunda experiencia científica, crean barreras significativas para nuevos competidores.
-
Flujos de Efectivo Estables: Una vez que un medicamento obtiene la aprobación y se comercializa bajo protección de patente, puede generar flujos de efectivo predecibles y consistentes durante su período de exclusividad.
1.4. Panorama General de los Riesgos y Oportunidades ⚠️
A pesar de su atractivo, el sector farmacéutico presenta un conjunto único de riesgos y oportunidades que los inversores deben sopesar cuidadosamente:
-
Oportunidades: El descubrimiento de terapias transformadoras, la expansión a mercados emergentes con crecientes necesidades de salud y los avances en la medicina de precisión ofrecen vías significativas para el crecimiento y la creación de valor.
-
Riesgos: Los desafíos son considerables e incluyen:
-
-
El alto riesgo de fracaso en los ensayos clínicos
-
La amenaza constante de la expiración de patentes (conocida como "patent cliff")
-
La intensa competencia de medicamentos genéricos y biosimilares
-
La creciente presión regulatoria sobre los precios de los medicamentos, os gobiernos y los pagadores de servicios de salud están ejerciendo una presión cada vez mayor para controlar los precios de los medicamentos, buscando reducir el gasto sanitario.
-
Además, los largos y costosos ciclos de desarrollo de fármacos implican que las empresas deben sostener inversiones significativas durante años antes de ver un retorno.
-
-
2. Tipos de Empresas Farmacéuticas 💊
El sector farmacéutico no es monolítico; está compuesto por diversos tipos de empresas, cada una con un modelo de negocio, perfil de riesgo y oportunidades de inversión distintos.
2.1. Big Pharma (Grandes Farmacéuticas) 🏢
Las "Big Pharma" son corporaciones multinacionales, caracterizadas por sus amplias carteras de productos, presencia global y una historia consolidada en la industria. Su modelo de negocio se basa en una integración vertical, abarcando desde la investigación y desarrollo (I+D) hasta la comercialización y distribución de medicamentos. Se enfocan en el desarrollo de "blockbusters", medicamentos con ventas multimillonarias, y diversifican sus esfuerzos en múltiples áreas terapéuticas.
Estas empresas invierten masivamente en I+D, con presupuestos que pueden oscilar entre el 14% y el 50% de sus ingresos.
Por ejemplo, Merck & Co. destinó $30.5 mil millones a I+D en 2023, lo que representó el 50.8% de sus ingresos, con más de la mitad de esta inversión dedicada a asociaciones y adquisiciones estratégicas. AstraZeneca y Novartis también muestran altas proporciones de I+D a ingresos, con 23.9% y 30.1% respectivamente en 2023. Sus carteras de productos son extensas, incluyendo medicamentos de marca, algunos genéricos, biológicos y terapias avanzadas.
La alta proporción de inversión en I+D en las Big Pharma, que a menudo incluye adquisiciones de empresas más pequeñas con pipelines prometedores, representa una estrategia tanto defensiva como ofensiva. Defensivamente, busca contrarrestar la pérdida de ingresos por el "patent cliff", mientras que ofensivamente, apunta a mantener el crecimiento y la relevancia en el mercado.
2.2. Biotech (Empresas Biotecnológicas) 🧪
Las empresas biotecnológicas son generalmente más pequeñas y jóvenes que las Big Pharma, y su enfoque principal radica en la innovación y el desarrollo de terapias biológicas y avanzadas. Son pioneras en áreas de vanguardia como la ingeniería genética, terapias celulares, terapias génicas y medicamentos basados en nucleótidos. Su objetivo es abordar enfermedades previamente intratables, como el cáncer y la insuficiencia orgánica.
El valor de estas empresas reside casi por completo en su pipeline de investigación. El éxito de un solo medicamento puede transformar radicalmente su posición en el mercado. Sin embargo, enfrentan desafíos significativos en cuanto a financiación y rentabilidad. Han experimentado una "crisis de financiación" en mercados bajistas, lo que las ha presionado a reducir costos y extender su "runway" o periodo de operación con el capital disponible.
Además, casi el 90% de las empresas biotecnológicas de EE. UU. dependen de importaciones para al menos la mitad de los componentes de sus productos, lo que las expone a riesgos en la cadena de suministro. La complejidad y los altos costos de los ensayos clínicos también representan barreras significativas. La mayoría de las biotecnológicas en etapas tempranas no generan ingresos y su éxito depende enteramente de la aprobación de sus medicamentos. Esto se traduce en una dependencia constante del capital de riesgo o de las asociaciones estratégicas con Big Pharma. Una "crisis de financiación" puede ser devastadora, llevando a despidos masivos o incluso a la quiebra, a pesar de que la ciencia subyacente pueda ser prometedora.
2.3. Specialty Pharma (Farmacéuticas Especializadas) 🎯
Las farmacéuticas especializadas se distinguen por su enfoque en el desarrollo y la comercialización de medicamentos para nichos de mercado específicos, a menudo relacionados con enfermedades raras o condiciones que requieren tratamientos complejos. Su cartera de productos puede incluir medicamentos de marca, genéricos especializados o productos de venta libre (OTC).
Estas empresas suelen operar con equipos de ventas y marketing más pequeños y altamente dirigidos, lo que les permite beneficiarse de una menor competencia en sus segmentos de mercado. Se concentran en medicamentos de alto costo que, por su naturaleza, requieren administración o monitoreo especializados.
En términos de valoración, las empresas de farmacia especializada han demostrado un rendimiento superior al mercado general.Los múltiplos de valoración, para empresas de servicios biofarmacéuticos (que a menudo se superponen o sirven a este segmento) han mostrado un aumento.
El crecimiento explosivo proyectado en el gasto en farmacia especializada indica una oportunidad de inversión en un segmento que combina la innovación con un modelo de negocio más enfocado y, potencialmente, menos expuesto a la competencia masiva de genéricos. A medida que la I+D se vuelve más sofisticada, se descubren tratamientos para enfermedades raras o muy específicas. Estos medicamentos, aunque suelen ser costosos, a menudo tienen menos alternativas terapéuticas y, por lo tanto, una menor presión competitiva que los "blockbusters" dirigidos a mercados masivos. La proyección de crecimiento del mercado de farmacia especializada indica una demanda creciente y una disposición de los sistemas de salud a pagar por soluciones para necesidades médicas no cubiertas.
2.4. Genéricos (Fabricantes de Medicamentos Genéricos) 🔄
Los fabricantes de medicamentos genéricos producen versiones bioequivalentes de fármacos de marca una vez que sus patentes originales expiran. Su modelo de negocio se basa en la eficiencia de fabricación, la optimización rigurosa de la cadena de suministro y el aprovechamiento de las economías de escala. A diferencia de las empresas innovadoras, no incurren en los altos costos asociados con la I+D y el marketing de los medicamentos de marca.
La competencia en el mercado de genéricos es intensa, lo que impulsa los precios a la baja. Los medicamentos genéricos son, en promedio, entre un 80% y un 85% más baratos que sus contrapartes de marca. Esta asequibilidad mejora significativamente el acceso a medicamentos esenciales para un amplio segmento de la población.
La industria de genéricos se beneficia directamente del "patent cliff" de los medicamentos de marca que enfrentan las Big Pharma. Cuando un medicamento de marca pierde su patente, los fabricantes de genéricos pueden entrar en el mercado con versiones de bajo costo, lo que provoca una caída drástica en las ventas y precios del medicamento original. Para los inversores, esto significa que mientras la expiración de patentes es una amenaza para las grandes farmacéuticas, es una oportunidad de crecimiento para las empresas de genéricos. La capacidad de una empresa de genéricos para identificar y lanzar rápidamente versiones de medicamentos "off-patent" y lograr economías de escala es crucial para su éxito.
2.5. Empresas de Plasma (Terapias Derivadas del Plasma) 🩸
Las empresas de plasma se especializan en la recolección de plasma humano y la fabricación de terapias derivadas de este, que contienen proteínas de incalculable valor terapéutico. Su modelo de negocio a menudo está verticalmente integrado, cubriendo todo el proceso desde la recolección de plasma a través de extensas redes de centros de donación hasta la producción y comercialización de los medicamentos finales. Grifols, por ejemplo, es un líder global en este campo con más de 390 centros de donación en todo el mundo.
Estas empresas se enfocan en el tratamiento de afecciones crónicas, raras y, en ocasiones, potencialmente mortales, como inmunodeficiencias y hemofilia. La cadena de valor del plasma es un proceso complejo y riguroso que garantiza los más altos estándares de calidad y seguridad, desde la donación inicial hasta la entrega final del medicamento al paciente.
Las empresas de plasma, al concentrarse en terapias para enfermedades raras que requieren un proceso de producción complejo y una cadena de suministro altamente controlada, operan en un nicho de mercado con barreras de entrada significativas y una menor exposición a la competencia de genéricos o biosimilares. Esta situación puede traducirse en márgenes estables y una alta rentabilidad. A diferencia de los medicamentos de moléculas pequeñas, las terapias derivadas del plasma son productos biológicos complejos que exigen una infraestructura especializada para la recolección de la materia prima (plasma) y un proceso de fabricación intrincado. Esto crea altas barreras de entrada para nuevos competidores, lo que limita la competencia de genéricos o biosimilares. Además, su enfoque en enfermedades raras a menudo implica que los precios son más elevados y la demanda es inelástica, lo que contribuye a la estabilidad y previsibilidad de los márgenes de beneficio. Esto hace que estas empresas sean atractivas para inversores que buscan estabilidad y crecimiento en segmentos de mercado protegidos.
2.6. Fabricación a Terceros (Contract Manufacturing - CMO/CDMO) 🏭
La industria farmacéutica, caracterizada por su complejidad y altos costos, ha visto el surgimiento de un modelo de negocio crucial: la fabricación a terceros, conocida como Contract Manufacturing Organizations (CMOs) o, de forma más abarcadora, Contract Development and Manufacturing Organizations (CDMOs). Estas empresas se especializan en ofrecer servicios de desarrollo y fabricación a otras compañías farmacéuticas y biotecnológicas, permitiéndoles externalizar parcial o totalmente sus procesos de producción.
El modelo de negocio de una CMO/CDMO se fundamenta en la provisión de una amplia gama de servicios que van desde la fase de investigación y desarrollo temprano hasta la fabricación comercial a gran escala. Esto incluye el desarrollo de procesos, la producción de principios activos farmacéuticos (APIs), la formulación de medicamentos, el envasado, el control de calidad y, en muchos casos, los servicios regulatorios necesarios para la aprobación de los productos. Al externalizar estas funciones, las empresas farmacéuticas pueden concentrarse en sus competencias principales, como la investigación y el marketing, reducir sus gastos de capital, optimizar sus costos operativos y acelerar el tiempo de llegada al mercado de sus productos.
Una de las principales ventajas para las empresas que contratan a una CMO/CDMO es la flexibilidad. Las empresas más pequeñas, especialmente las biotecnológicas en fase de desarrollo, a menudo carecen de la infraestructura y la experiencia necesarias para la fabricación. Recurrir a una CMO les permite escalar su producción según sea necesario, sin la necesidad de realizar inversiones masivas en plantas e instalaciones. Para las Big Pharma, la externalización puede ser una estrategia para gestionar picos de demanda, diversificar su cadena de suministro o acceder a tecnologías de fabricación especializadas que no poseen internamente.
La propuesta de valor de una CMO/CDMO radica en su experiencia técnica, su capacidad de producción y su estricto cumplimiento normativo. Operan bajo las rigurosas Buenas Prácticas de Fabricación (GMP), asegurando que los productos fabricados cumplan con los más altos estándares de calidad y seguridad exigidos por las agencias reguladoras de todo el mundo. Su eficiencia deriva de la optimización de sus procesos y de las economías de escala que logran al servir a múltiples clientes.
Un ejemplo relevante de este modelo en España es Rovi. Aunque Rovi es conocida por su propia cartera de productos farmacéuticos, también se ha consolidado como una importante CDMO, especialmente en el ámbito de la fabricación de inyectables. Su experiencia en el desarrollo y la fabricación de medicamentos complejos, combinada con sus modernas instalaciones, la ha posicionado como un socio estratégico para otras compañías farmacéuticas que buscan externalizar la producción de sus terapias inyectables. Durante la pandemia de COVID-19, por ejemplo, Rovi desempeñó un papel crucial en la fabricación de vacunas para terceros, demostrando la importancia estratégica de las CDMOs en la cadena de suministro global de medicamentos.
La inversión en empresas de fabricación a terceros puede ser atractiva por varias razones. Ofrecen una exposición a la industria farmacéutica con un perfil de riesgo diferente. A diferencia de las empresas biotecnológicas que dependen del éxito de un número limitado de medicamentos en desarrollo, o de las Big Pharma con sus ciclos de patentes, las CDMOs se benefician de la actividad general de I+D y fabricación de toda la industria. Su crecimiento está impulsado por la tendencia creciente hacia la externalización y la necesidad de capacidades de fabricación especializadas. Además, al servir a múltiples clientes y productos, su modelo de negocio tiende a ser más diversificado y menos dependiente del éxito de un único fármaco. Sin embargo, también enfrentan desafíos, como la intensa competencia, la necesidad de inversiones continuas en tecnología y la dependencia de los contratos con sus clientes.
2.7. REITs Especializados en Ciencias de la Vida🔬🏢
Dentro del vasto universo de la inversión inmobiliaria, los Fondos de Inversión Inmobiliaria (REITs, por sus siglas en inglés) han evolucionado para especializarse en nichos de mercado muy específicos. Un segmento particularmente interesante y de creciente importancia es el de los REITs que se enfocan en proveer espacios de oficina y laboratorio altamente especializados, principalmente a empresas de los sectores de ciencias de la vida, agrotecnología y tecnología. Alexandria Real Estate Equities, Inc. (NYSE: ARE) es un claro exponente de este modelo.
Un REIT, por definición, es una compañía que posee, opera o financia propiedades inmobiliarias que producen ingresos. Los REITs especializados en ciencias de la vida, como Alexandria, se distinguen por su enfoque en la provisión de infraestructura crítica para la investigación, el desarrollo y la producción en sectores de alta tecnología y crecimiento. Sus propiedades no son oficinas convencionales; son instalaciones construidas o adaptadas específicamente para albergar laboratorios de última generación, salas limpias, centros de I+D, vivarios y otras infraestructuras especializadas que las empresas biotecnológicas, farmacéuticas y tecnológicas requieren para sus operaciones.
El modelo de negocio de Alexandria se basa en la adquisición, desarrollo y gestión de estos complejos de laboratorio y oficina en clústeres geográficos clave, que suelen ser centros neurálgicos de innovación biotecnológica y tecnológica. Estos clústeres, como Boston/Cambridge, San Francisco Bay Area, San Diego, Seattle, Nueva York y Maryland, se caracterizan por una alta concentración de instituciones académicas de investigación, hospitales, empresas de ciencias de la vida (tanto startups como grandes corporaciones) y una fuerza laboral altamente cualificada. La proximidad a estos ecosistemas de innovación es un factor crítico de su éxito.
La propuesta de valor de Alexandria para sus inquilinos va más allá del simple alquiler de espacio. Ofrecen un entorno de trabajo colaborativo y de alta tecnología, servicios de infraestructura de laboratorio que pueden incluir sistemas especializados de ventilación, seguridad y gestión de residuos, y una profunda comprensión de las necesidades específicas de la investigación científica. Al hacerlo, permiten que sus inquilinos se centren en su ciencia y sus descubrimientos, externalizando la complejidad de la gestión de instalaciones altamente especializadas.
Para los inversores, un REIT como Alexandria ofrece una forma única de obtener exposición al crecimiento de la industria de las ciencias de la vida sin invertir directamente en el riesgo de los ensayos clínicos o el desarrollo de medicamentos. En cambio, se benefician del alquiler de la infraestructura necesaria para que estas industrias prosperen.
2.8. Empresas de Royalty Farmacológico 💰
Las empresas de royalty farmacológico representan un modelo de negocio singular dentro de la industria, diferenciándose al no dedicarse directamente a la investigación, desarrollo o fabricación de medicamentos. En su lugar, se enfocan en adquirir derechos de royalty sobre medicamentos aprobados y en fase de desarrollo, así como participaciones en los ingresos futuros generados por terapias innovadoras. Ejemplos prominentes de este tipo de empresa son Royalty Pharma.
El modelo operativo es relativamente sencillo: estas compañías proporcionan financiación no dilutiva (es decir, sin emitir nuevas acciones que diluyan la participación de los accionistas existentes) a empresas farmacéuticas y biotecnológicas, a cambio de un porcentaje de las ventas futuras de sus productos. Esta financiación puede utilizarse para impulsar la investigación y el desarrollo de nuevos medicamentos, financiar ensayos clínicos, expandir operaciones o incluso para fines generales corporativos.
Para los inversores, este modelo ofrece varias ventajas:
-
Menor riesgo directo de I+D: No asumen los altos costos y la alta tasa de fracaso asociados con la investigación y el desarrollo de medicamentos desde cero. Su riesgo está más ligado al éxito comercial de medicamentos ya en fases avanzadas o ya aprobados.
-
Flujos de caja predecibles: Una vez que los medicamentos generadores de royalties están en el mercado, proporcionan flujos de caja recurrentes y, en muchos casos, predecibles, lo que puede resultar atractivo en comparación con la volatilidad de las empresas biotecnológicas en etapa de desarrollo.
-
Diversificación: Al poseer derechos sobre múltiples medicamentos y terapias, el impacto del fracaso o la baja venta de un solo producto se minimiza.
-
Exposición al crecimiento de la industria: Se benefician del éxito general de la innovación farmacéutica y biotecnológica, sin la necesidad de construir una infraestructura de investigación o fabricación.
Sin embargo, también existen desafíos:
-
Dependencia del éxito de terceros: Su rentabilidad depende enteramente del éxito de los medicamentos de otras compañías y de la efectividad de sus estrategias de comercialización.
-
Riesgo de patent cliff: Al igual que las Big Pharma, los royalties pueden verse afectados cuando los medicamentos pierden sus patentes y enfrentan competencia de genéricos.
-
Valoración: La valoración de estos activos puede ser compleja, ya que implica proyecciones de ventas futuras y la duración de la exclusividad de la patente.
3. El Proceso de Desarrollo de un Medicamento: De la Molécula al Mercado 🔬
El camino que una molécula debe recorrer desde su descubrimiento hasta su aprobación regulatoria es notoriamente largo, costoso y propenso al fracaso. Comprender cada etapa es crucial para evaluar el riesgo y el potencial de retorno en la inversión farmacéutica.
3.1. Fase de Descubrimiento (Discovery) 🔍
La fase de descubrimiento es el punto de partida del desarrollo de un medicamento, cuyo propósito es identificar nuevas moléculas, compuestos o biológicos que tengan el potencial de tratar o prevenir enfermedades. Este proceso se inicia con la identificación y validación de un "target" biológico, como una proteína, un receptor, una enzima o un gen, que sea fundamental para la patología de una enfermedad específica.
Durante esta etapa, se evalúan variables críticas como la prevalencia de la enfermedad, las necesidades médicas no cubiertas por tratamientos existentes y las opciones terapéuticas actuales. El objetivo es encontrar moléculas que interactúen con el target identificado. Esto se logra mediante técnicas de cribado de alto rendimiento (high-throughput screening) para identificar "hits", que luego son optimizados para mejorar su potencia, selectividad y seguridad, convirtiéndose en "leads" o moléculas candidatas prometedoras.
La tasa de éxito en esta fase es extremadamente baja: solo 1 de cada 5,000 compuestos que entran en la fase de descubrimiento y progresan al desarrollo preclínico llega a convertirse en un medicamento aprobado. Esta fase, combinada con la preclínica, puede extenderse entre 4 y 7 años.
La fase de descubrimiento, aunque es el génesis de la innovación farmacéutica, es también la etapa con la mayor incertidumbre y la menor tasa de éxito. Esto hace que la inversión en esta etapa sea extremadamente especulativa y de alto riesgo. La ínfima probabilidad de que un compuesto descubierto llegue a ser un medicamento aprobado (1 en 5,000) significa que la gran mayoría de la inversión en esta fase se "pierde" sin generar un producto comercializable. Para los inversores, esto se traduce en que las empresas con un gran número de programas en fase de descubrimiento son inherentemente muy volátiles. La clave para mitigar este riesgo es la diversificación de la cartera de I+D y la capacidad de la empresa para identificar rápidamente los "fracasos" y redirigir los recursos hacia los proyectos más prometedores, lo que se conoce como "disciplina de capital" en I+D.
3.2. Fase Preclínica (Preclinical Development) 🧪
Una vez que se identifica una molécula candidata prometedora, el siguiente paso es la fase preclínica, cuyo propósito es evaluar su viabilidad, seguridad y toxicidad potencial antes de que pueda ser probada en humanos. Esta etapa implica una serie de pruebas de laboratorio, incluyendo estudios in vitro (utilizando cultivos celulares) e in vivo (realizados en animales).
Los estudios clave en esta fase incluyen la farmacodinámica (PD), que investiga qué efectos tiene el fármaco en el cuerpo, y la farmacocinética (PK), que analiza cómo el cuerpo procesa el fármaco, incluyendo su absorción, distribución, metabolismo y excreción (ADME). Un componente crítico es la toxicología, que busca determinar la toxicidad aguda y a corto plazo del fármaco en al menos dos especies de animales, una de las cuales debe ser no roedora. A partir de estos estudios, se establecen los niveles sin efecto adverso observado (NOAELs), que son fundamentales para determinar la dosis inicial segura en los ensayos clínicos de Fase I.
Todos estos estudios deben adherirse estrictamente a las Buenas Prácticas de Laboratorio (GLP), garantizando la fiabilidad y la calidad de los datos para su presentación a las agencias reguladoras FDA (EE. UU.) o EMA (Europa).. Esta fase suele durar entre 3 y 6 años y puede costar entre $300 millones y $600 millones.
La fase preclínica es un cuello de botella crítico en el proceso de desarrollo de fármacos, donde la mayoría de los compuestos son descartados debido a problemas de seguridad o viabilidad. Esto subraya la importancia de la robustez científica y la inversión en tecnologías que permitan una detección temprana de fallos. A pesar de los altos costos y la duración, la fase preclínica es fundamental para garantizar la seguridad antes de las pruebas en humanos. Los requisitos de pruebas en múltiples especies y la estricta adherencia a las GLP buscan minimizar los riesgos. Sin embargo, muchos compuestos fallan en esta etapa debido a toxicidad inesperada o falta de eficacia en modelos biológicos. Las empresas que invierten en inteligencia artificial (IA), aprendizaje automático (ML) y tecnologías como "organ-on-a-chip" para mejorar la predicción de ADMET y toxicidad pueden reducir significativamente el costo y el tiempo de esta fase, lo que aumenta la eficiencia de la I+D y, en última instancia, el valor para el inversor.
ADMET es un acrónimo utilizado en farmacología y desarrollo de fármacos. Significa:
-
A – Absorción: cómo el fármaco entra al cuerpo (por ejemplo, vía oral).
-
D – Distribución: cómo se reparte en los tejidos y órganos.
-
M – Metabolismo: cómo se transforma, principalmente en el hígado.
-
E – Excreción: cómo se elimina (por orina, bilis, etc.).
-
T – Toxicidad: posibles efectos adversos o daño que puede causar.
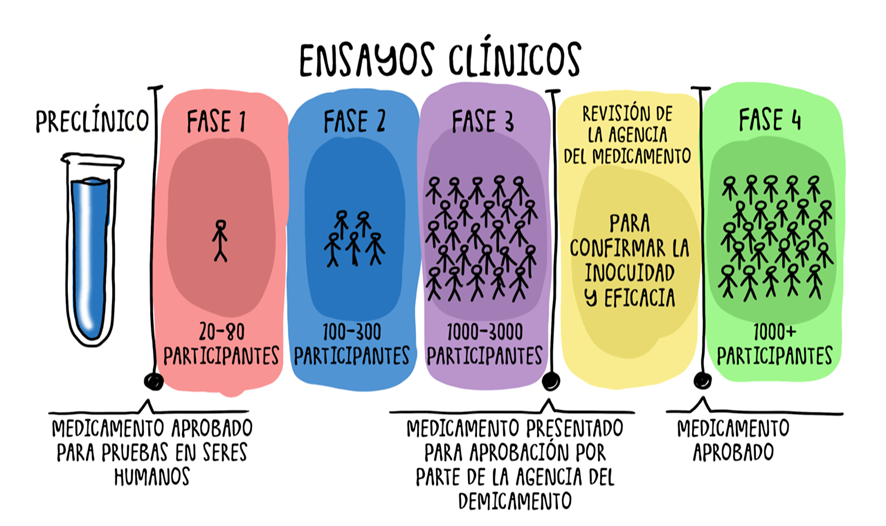
3.3. Fases Clínicas en Humanos (Clinical Trials) 🧑⚕️
Una vez completada la fase preclínica y obtenida la autorización de la autoridad reguladora (a través de una solicitud IND en EE. UU. o CTA en la UE), el medicamento candidato puede avanzar a las fases clínicas en humanos.
3.3.1. Fase I: Seguridad y Dosificación 🛡️
La Fase I es el primer contacto de un medicamento con seres humanos, y su propósito principal es evaluar la seguridad, la tolerabilidad, la farmacocinética y la farmacodinámica, así como determinar la dosis máxima tolerada (MTD). Estos estudios involucran a un pequeño número de voluntarios, generalmente entre 10 y 30 personas (los números varían en función de la fuente consultada), que suelen ser sanas, aunque en el ámbito de la oncología pueden ser pacientes con la enfermedad.
Los primeros participantes reciben dosis muy bajas del tratamiento, que se aumentan gradualmente bajo una estrecha supervisión médica. En esta fase, no se utilizan placebos. La Fase I es considerada la etapa con mayor riesgo potencial para los participantes, dado que es la primera vez que el fármaco se administra en humanos. En cuanto a su duración y costo, puede costar entre $1.5 millones y $6 millones por fármaco, con una duración de 2 años, duración promedio de 22 meses. La probabilidad de que un medicamento avance de Fase I a Fase II es de aproximadamente 60% a 66% (los números varían en función de la fuente consultada), y las interrupciones en esta etapa suelen deberse a la falta de tolerabilidad.
La transición exitosa de Fase I a Fase II es un indicador temprano crucial de la viabilidad de un medicamento, pero el riesgo inherente de esta fase inicial significa que las empresas con múltiples candidatos en Fase I son altamente especulativas. Aunque la tasa de éxito de Fase I a Fase II parece alta (60-66%), es importante recordar que la mayoría de los compuestos ya han sido eliminados en fases anteriores. El objetivo principal de la Fase I es la seguridad, no la eficacia. Un fracaso en esta etapa debido a toxicidad inesperada puede detener completamente un programa de desarrollo, lo que resulta en una pérdida total de la inversión acumulada hasta ese momento.
3.3.2. Fase II: Eficacia Preliminar y Dosis Óptima 💊
La Fase II se enfoca en evaluar la eficacia preliminar del tratamiento y determinar las dosis óptimas, frecuencias y vías de administración. En esta etapa, se involucra a un grupo más grande de pacientes que padecen la enfermedad de interés, generalmente entre 25 y 100 personas (los números varían en función de la fuente consultada). El tratamiento se administra utilizando la dosis y el método que se consideraron más seguros en la Fase I. Al igual que en la Fase I, no se utilizan placebos en estos estudios.
La duración típica de la Fase II es de hasta 3 años, con una duración promedio de 34 meses (los números varían en función de la fuente consultada). La probabilidad de que un medicamento avance de Fase II a Fase III es de aproximadamente 58.3%.(los números varían en función de la fuente consultada) Esta es la fase donde el desarrollo de un medicamento es más propenso a terminar.
La Fase II es el punto de inflexión más crítico para la mayoría de los programas de desarrollo de fármacos, ya que es la primera vez que se evalúa la eficacia del medicamento en pacientes, y es donde la mayoría de los proyectos fallan. Un resultado positivo puede disparar el valor de la empresa, mientras que un resultado negativo puede provocar un colapso. La alta tasa de fracaso en esta fase se debe a que la eficacia observada en modelos animales no siempre se traduce de manera efectiva en humanos, o a que el efecto no es lo suficientemente significativo como para justificar el avance a la siguiente etapa. Los inversores deben prestar especial atención a los "endpoints" (criterios de valoración) de los ensayos de Fase II y a la solidez estadística de los resultados.
3.3.3. Fase III: Eficacia Confirmatoria y Comparación con Estándar 🏆
La Fase III es la etapa final de los ensayos clínicos antes de la solicitud de aprobación regulatoria. Su propósito principal es confirmar la seguridad y eficacia del nuevo tratamiento en una población de pacientes mucho más grande y compararlo directamente con el tratamiento estándar existente. Estos estudios involucran a un número significativamente mayor de pacientes, generalmente al menos 1,000 personas (los números varían en función de la fuente consultada), lo que permite detectar efectos secundarios menos comunes y confirmar la eficacia en una población más diversa.
Los estudios de Fase III son más largos que los de Fase I y II, con una duración promedio de 50 meses. Pueden incluir placebos si no existe un tratamiento estándar éticamente aceptable, y se monitorean de cerca los efectos secundarios a largo plazo. La probabilidad de que un candidato en Fase III obtenga la autorización de comercialización es de alrededor del 50% al 60%.(los números varían en función de la fuente consultada) Una vez que la solicitud de comercialización ha sido presentada a la autoridad reguladora, la probabilidad de obtener la autorización aumenta considerablemente, situándose en torno al 90%.
No obstante, los fracasos en Fase III, aunque menos frecuentes, son los más costosos en términos de inversión acumulada. Además, incluso con la aprobación regulatoria, el éxito comercial depende de factores como la fijación de precios, el reembolso por parte de los sistemas de salud y el acceso efectivo al mercado. Una estrategia deficiente en estas áreas puede llevar a que un medicamento aprobado no genere los ingresos esperados, afectando negativamente el valor para el inversor. Esto resalta que la inversión en farmacéuticas va más allá de la ciencia, abarcando también la estrategia comercial y de mercado.
Tabla: Fases del Desarrollo de un Medicamento📈
|
Fase |
Propósito Principal |
Número de Sujetos |
Duración Promedio |
Costo Estimado (por fármaco) |
Tasa de Éxito (a la siguiente fase/aprobación) |
|
Descubrimiento |
Identificar moléculas con potencial terapéutico |
N/A |
4-7 años (con preclínica) |
N/A (parte del costo preclínico) |
1 de cada 5,000 compuestos llega a aprobación |
|
Preclínica |
Evaluar seguridad y toxicidad antes de humanos |
Animales (2+ especies) 28 |
3-6 años |
$300M - $600M |
N/A (pre-clínica) |
|
Fase I |
Seguridad, tolerabilidad, dosificación |
10-30 voluntarios |
22.1 meses |
$1.5M - $6M |
60-66.4% a Fase II |
|
Fase II |
Eficacia preliminar, dosis óptima |
25-100 pacientes |
34.0 meses |
N/A (parte del costo total) |
58.3% a Fase III |
|
Fase III |
Eficacia confirmatoria, comparación con estándar |
1,000+ pacientes |
44.9 meses |
N/A (parte del costo total) |
50-60% a aprobación |
|
Aprobación |
Revisión regulatoria final |
N/A |
Variable |
N/A (parte del costo total) |
~90% una vez presentada la solicitud |
4. Factores Clave en el Sector Farmacéutico 📈
Al evaluar oportunidades de inversión en la industria farmacéutica, es fundamental considerar una serie de elementos que influirán directamente en el rendimiento y la viabilidad de una empresa.
4.1. El Pipeline (Cartera de Productos en Desarrollo) 🧪
Los medicamentos en fases avanzadas, especialmente en Fase III, conllevan un riesgo significativamente menor y un valor más predecible, ya que han superado las etapas más críticas del desarrollo.
La diversificación del pipeline es igualmente importante. La calidad y la diversificación del pipeline son más importantes que la mera cantidad de medicamentos en desarrollo, ya que un pipeline robusto y estratégico es la principal defensa de una empresa farmacéutica contra el "patent cliff" y la clave para el crecimiento a largo plazo. Dado que los medicamentos de marca pueden perder casi todo su valor tras la expiración de la patente, la capacidad de una empresa para reponer sus ingresos depende enteramente de la fortaleza y el éxito de su pipeline. Un pipeline lleno de "me-too drugs" (medicamentos que ofrecen poca mejora sobre los existentes) o concentrado en una sola área terapéutica de alto riesgo (como la oncología, que históricamente tiene una tasa de éxito más baja) es menos valioso que uno con terapias verdaderamente innovadoras y diversificadas. Los inversores deben buscar empresas que no solo tengan muchos candidatos, sino que también demuestren una estrategia de I+D que aborde necesidades médicas no cubiertas y que esté protegida por una sólida propiedad intelectual.
4.2. Valor del Mercado Objetivo 🎯
El valor del mercado objetivo de un medicamento es un factor determinante de su potencial de ingresos. La prevalencia de la enfermedad y el número de pacientes potenciales definen el tamaño del mercado direccionable. Sin embargo, el precio al que se puede vender un medicamento y la disposición de los sistemas de salud (pagadores) a reembolsarlo son igualmente cruciales.
Por ejemplo, los medicamentos para enfermedades raras, aunque dirigidos a poblaciones de pacientes más pequeñas (menos de 200,000 en EE. UU. según la FDA), a menudo permiten precios más altos debido a la escasez de alternativas y la gran necesidad médica no cubierta. El mercado de enfermedades raras está experimentando un crecimiento significativo, con una expansión estimada de $215 mil millones en 2023 a más de $540 mil millones para 2032.
Históricamente, las terapias para enfermedades raras eran consideradas "vacas lecheras" debido a sus altos precios y la falta de competencia.5 Sin embargo, a medida que más terapias para enfermedades raras llegan al mercado (más de 170 aprobadas por la FDA desde 2020), los pagadores (aseguradoras, gobiernos) están desarrollando estrategias para controlar el gasto. Esto incluye un mayor énfasis en el precio neto y los costos directos de tratamiento, así como una preferencia por contratos basados en valor. Para los inversores, esto significa que el simple hecho de que un medicamento sea para una enfermedad rara ya no garantiza una rentabilidad ilimitada; la capacidad de la empresa para demostrar un valor clínico superior y negociar acuerdos de reembolso favorables será cada vez más importante para asegurar el éxito comercial.
4.3. Impacto de la Regulación (FDA, EMA) 🏛️
Los organismos reguladores, como la Administración de Alimentos y Medicamentos (FDA) en EE. UU. y la Agencia Europea de Medicamentos (EMA), desempeñan un papel central en la determinación de qué medicamentos pueden llegar al mercado. El proceso de aprobación es riguroso e implica extensas pruebas para garantizar la seguridad y eficacia de un fármaco.
Un medicamento que se retrasa o se le deniega la aprobación debido a obstáculos regulatorios puede generar pérdidas sustanciales, mientras que un entorno regulatorio favorable puede aumentar la confianza de los inversores. La probabilidad de que un medicamento progrese desde los ensayos clínicos de Fase I hasta la aprobación regulatoria es inferior al 12%, lo que subraya el riesgo inherente a esta fase.
El entorno regulatorio no solo determina la viabilidad de un medicamento, sino que también moldea las estrategias de I+D de las empresas y puede crear "efectos acantilado" adicionales en los ingresos, más allá de la expiración de patentes. Las regulaciones no solo impactan los tiempos de aprobación, sino también la rentabilidad futura de los medicamentos. Por ejemplo, la Ley de Reducción de la Inflación (IRA) en EE. UU. introduce negociaciones de precios para medicamentos de moléculas pequeñas después de 7 años y para biológicos después de 11 años, lo que puede resultar en una reducción de los ingresos del 25% al 40%. Esto crea un "efecto acantilado" adicional en los ingresos que los inversores deben considerar en sus modelos de valoración. Además, la exención de negociación para medicamentos huérfanos de indicación única puede influir en las decisiones de I+D de las empresas, dirigiéndolas hacia ciertos nichos para maximizar el retorno regulatorio.
4.4. Fusiones y Adquisiciones (M&A) 🤝
Las fusiones y adquisiciones (M&A) son una estrategia recurrente y vital en el sector farmacéutico, impulsadas por diversas razones estratégicas:
-
Reposición de Pipelines: Las Big Pharma adquieren empresas biotecnológicas con prometedores candidatos en desarrollo para compensar la expiración de patentes y mantener el crecimiento de sus ingresos.
-
Acceso a Nuevas Tecnologías: Las adquisiciones permiten a las empresas acceder a plataformas innovadoras, como terapias génicas o el uso de inteligencia artificial en el descubrimiento de fármacos.
-
Diversificación: Las M&A facilitan la expansión a nuevas áreas terapéuticas o mercados geográficos.
-
Economías de Escala: La consolidación puede generar eficiencias operativas y reducir los costos de I+D.
Los medicamentos preclínicos, que representan una etapa temprana del desarrollo, fueron el objetivo principal en el 16.2% de las M&A en 2022-2023, un aumento notable desde el 8.7% en 2010-2021.14 El impacto en el mercado es que las M&A pueden aumentar la concentración del mercado y, en algunos casos, se asocian con aumentos de precios de los medicamentos de marca y un mayor riesgo de escasez para los genéricos.
Las M&A en el sector farmacéutico son un mecanismo dual: sirven como estrategia de crecimiento y mitigación de riesgos para las grandes farmacéuticas, pero también pueden generar problemas de concentración de mercado y escasez de medicamentos, afectando el panorama competitivo y la disponibilidad para los pacientes. La adquisición de empresas biotecnológicas en etapas tempranas (preclínicas) por parte de Big Pharma demuestra la urgencia de reponer los pipelines frente al "patent cliff". Esto beneficia a las biotecnológicas al proporcionarles financiación y una vía de salida.
5. Análisis Financiero de Empresas Farmacéuticas 📊
La evaluación de una empresa farmacéutica requiere un análisis financiero riguroso que va más allá de las métricas tradicionales, considerando las particularidades de la industria.
5.1. Métricas de Rentabilidad (ROE, ROCE) 📈
El ROE (Return on Equity) mide la rentabilidad en relación con el capital propio de los accionistas, mientras que el ROCE (Return on Capital Employed) evalúa la eficiencia con la que una empresa utiliza todo su capital (deuda y capital propio) para generar beneficios. Dada la volatilidad de los beneficios en el sector farmacéutico, similar a la del petróleo, es útil promediar estos retornos a lo largo de un ciclo completo. En años favorables, el ROE de las grandes farmacéuticas puede superar el 20-30%, mientras que en periodos de crisis puede caer a valores de un dígito o incluso ser negativo.
Así como los precios del crudo impactan la rentabilidad de las petroleras, en el sector farmacéutico, el éxito o fracaso de un "blockbuster" o la expiración de una patente pueden causar fluctuaciones masivas en los ingresos y, por ende, en el ROE/ROCE. Un ROE alto en un año puede ser insostenible si se debe a un pico de ventas de un solo producto que está a punto de expirar. Los inversores deben buscar empresas que demuestren una capacidad constante para generar retornos sólidos a lo largo del tiempo, incluso con la presión de la expiración de patentes y la necesidad de reinvertir fuertemente en I+D. La "disciplina de capital", es relevante aquí: invertir solo en proyectos rentables y devolver el excedente a los accionistas.
5.2. CAPEX (Gastos de Capital) 💰
La industria farmacéutica, al igual que la petrolera, requiere un CAPEX (gasto de capital) elevado, no solo en infraestructura de producción, sino también en las inversiones masivas en I+D.1
La capacidad de una empresa farmacéutica para generar un Free Cash Flow robusto es un indicador vital de su salud financiera, especialmente dada la naturaleza intensiva en capital de la I+D y la necesidad de reinversión constante. El desarrollo de fármacos es un proceso que consume mucho capital. Una empresa puede mostrar beneficios contables, pero si su flujo de caja operativo no cubre su CAPEX (incluida la I+D), se verá obligada a endeudarse o a diluir a los accionistas. Un FCF positivo y creciente indica que la empresa puede financiar su crecimiento interno, pagar dividendos y recomprar acciones sin depender excesivamente de financiación externa. Esto es especialmente importante en un sector donde los ciclos de ingresos pueden ser volátiles debido a la expiración de patentes.
5.3. Márgenes Operativos (Margen Bruto, EBITDA) 📊
El EBITDA (Earnings Before Interest, Taxes, Depreciation, and Amortization) representa la rentabilidad central de las operaciones de una empresa, excluyendo gastos no monetarios y financieros.
Es importante tener en cuenta que el EBITDA puede verse afectado por eventos únicos, por lo que se recomienda utilizar un EBITDA "normalizado" para una valoración más precisa, ajustando por elementos no recurrentes.
El margen EBITDA es una métrica crucial para comparar la eficiencia operativa entre empresas farmacéuticas, ya que neutraliza las diferencias contables y de estructura de capital, pero debe ser "normalizado" para evitar distorsiones por eventos no recurrentes. Las empresas farmacéuticas pueden tener estructuras de deuda, políticas de depreciación y regímenes fiscales muy diferentes. El EBITDA permite una comparación más justa de la rentabilidad operativa subyacente.
Sin embargo, eventos como litigios, reestructuraciones o adquisiciones puntuales pueden inflar o desinflar el EBITDA de un período. Un analista debe ajustar estos "elementos no recurrentes" para obtener un EBITDA normalizado que refleje la capacidad de generación de beneficios a largo plazo de la empresa, lo que es esencial para una valoración precisa.
5.4. Gestión de la Deuda y Solidez del Balance 🛡️
Dada la naturaleza intensiva en capital y cíclica del sector farmacéutico, la gestión de la deuda es vital. Las métricas clave a analizar incluyen el ratio Deuda Neta/EBITDA, Deuda/Equity y la capacidad de la empresa para cubrir sus intereses. Las empresas con una deuda excesiva enfrentan un riesgo financiero significativo si sus ingresos caen bruscamente, por ejemplo, debido al fracaso de un medicamento clave o la expiración de una patente. La tendencia actual muestra que muchas grandes farmacéuticas han reducido sus deudas en los últimos años, utilizando los ingresos para pagar pasivos, lo que fortalece su posición financiera.
Un balance sólido con deuda moderada es crucial para que las empresas farmacéuticas soporten los "períodos de vacas flacas" (fracasos de ensayos, expiración de patentes) y mantengan la capacidad de invertir en innovación. El desarrollo de fármacos es un negocio de "todo o nada" en muchos casos; un solo fracaso en Fase III puede tener un impacto devastador en los ingresos y el flujo de caja. Una empresa con una deuda excesiva es mucho más vulnerable a estos choques. Un balance sólido permite a la empresa absorber pérdidas, continuar invirtiendo en I+D (que es una inversión a largo plazo) y mantener su calificación crediticia, lo que es vital para acceder a capital en el futuro. Los inversores deben priorizar empresas con una gestión financiera prudente que les permita navegar la volatilidad inherente del sector.
Métricas Clave para Empresas Farmacéuticas 📊
|
Métrica |
Definición |
Relevancia en Pharma |
Consideraciones para el Análisis |
|
Free Cash Flow (FCF) |
Flujo de caja operativo - CAPEX |
Capacidad para pagar dividendos y recomprar acciones. |
Indicador de salud financiera y flexibilidad para reinvertir. |
|
EBITDA |
Ganancias antes de intereses, impuestos, depreciación y amortización |
Rentabilidad operativa central, útil para comparar empresas. |
Normalizar por eventos únicos para una valoración precisa. |
|
Margen EBITDA |
EBITDA como % de ingresos |
Eficiencia operativa y capacidad de control de costos. |
Comparar con pares y tendencias históricas. |
|
EV/Ventas |
Valor de Empresa / Ventas anuales |
Útil para empresas con EBITDA bajo o negativo. |
Especialmente relevante para biotecnológicas en crecimiento. |
|
I+D como % de Ingresos |
Gasto en I+D / Ingresos totales |
Compromiso con la innovación y reposición del pipeline. |
Evaluar eficiencia y estrategia, no solo magnitud. |
|
Deuda Neta/EBITDA |
Deuda neta / EBITDA |
Capacidad de la empresa para pagar su deuda. |
Un ratio bajo indica solidez y resiliencia ante shocks. |
6. Modalidades de Inversión - Sector Farmacéutico 💼
Los inversores tienen diversas vías para obtener exposición al sector farmacéutico, cada una con sus propias características de riesgo y recompensa.
6.1. Inversión Directa en Acciones de Empresas Farmacéuticas 📈
La inversión directa en acciones permite a los inversores seleccionar empresas específicas basándose en un análisis detallado de su pipeline, la calidad de su gestión, su salud financiera y su estrategia de mercado. Esta modalidad ofrece el potencial de altos rendimientos si se elige una empresa con un medicamento "blockbuster" exitoso o un pipeline que genere múltiples aprobaciones. Sin embargo, conlleva un mayor riesgo específico de la empresa; el fracaso de un solo medicamento en ensayos clínicos o la expiración de una patente clave pueden impactar severamente el valor de la inversión. Por lo tanto, requiere una investigación profunda y un seguimiento constante de las noticias y desarrollos de la empresa. Al considerar esta opción, es fundamental evaluar el tipo de empresa (Big Pharma, Biotech, Genéricos, Plasma) y su perfil de riesgo/recompensa inherente.
6.2. ETFs (Exchange Traded Funds) y Fondos Especializados en el Sector 📊
Los ETFs (Exchange Traded Funds) y los fondos especializados ofrecen una forma diversificada de invertir en el sector farmacéutico con una sola transacción. Estos fondos replican índices de empresas biotecnológicas o farmacéuticas, distribuyendo el riesgo entre múltiples compañías.
Existen diferentes tipos de ETFs que se adaptan a distintas estrategias de inversión:
-
Small-cap biotech ETFs: Se enfocan en empresas biotecnológicas emergentes con menor capitalización de mercado. Estas compañías pueden estar en etapas tempranas de desarrollo de fármacos y, por lo tanto, son más volátiles, pero también ofrecen un alto potencial de crecimiento.
-
Pharmaceutical sector ETFs: Son fondos más amplios que incluyen tanto empresas biotecnológicas como grandes fabricantes de medicamentos.
Al elegir un ETF, es crucial considerar varios aspectos:
-
Principales Participaciones y Ponderación: Es importante revisar si el ETF está dominado por grandes farmacéuticas, que ofrecen más estabilidad, o por biotecnológicas más pequeñas, que presentan mayor potencial de crecimiento junto con mayor riesgo.
-
Ratio de Gastos (Expense Ratio): Esta es la tarifa anual cobrada por el ETF. Los ETFs especializados en biotecnología o farmacéutica suelen tener ratios de gastos ligeramente más altos.
-
Estrategia del Fondo: Se debe determinar si el ETF es pasivo (simplemente sigue un índice) o activo (gestionado por profesionales que seleccionan activamente acciones). Los fondos activos suelen tener tarifas más altas.
-
Dividendos: Algunos ETFs de biotecnología pagan dividendos, como el iShares Biotechnology ETF (IBB) o el SPDR S&P Biotech ETF (XBI).
Un ETF de "small-cap biotech" será mucho más volátil que un ETF de "large pharmaceutical firms", reflejando los perfiles de riesgo de las empresas subyacentes. Los inversores deben elegir un ETF cuya estrategia se alinee con su tolerancia al riesgo y sus objetivos de inversión, prestando atención a las comisiones y las principales participaciones.
Glosario de Términos Claves
- ANDA (Abbreviated New Drug Application): Solicitud para aprobar un medicamento genérico sin repetir estudios de eficacia.
- Acelerated Development: Vía rápida para aprobación de medicamentos críticos.
- Biological Drugs: Medicamentos biotecnológicos más complejos de fabricar.
- Drug Lag & Drug Loss: Retraso y pérdidas en la aprobación de fármacos.
- Ethical Drugs: Medicamentos de prescripción.
- GLP: Good Laboratory Practice.
- IND (Investigational New Drug): Solicitud para iniciar estudios en humanos.
- NCE (New Chemical Entities): Nuevas moléculas en investigación.
- NDA (New Drug Application): Solicitud de aprobación de un nuevo fármaco.
- Complete Response Letter: Documento del regulador explicando un rechazo con posibilidad de reevaluación.
- Drug Label & Black Boxes: Advertencias en medicamentos aprobados sobre efectos adversos.
- Orphan Drug Act: Regulación que incentiva el desarrollo de medicamentos para enfermedades raras.
- OTC (Over-the-Counter): Medicamentos sin receta.
- PDUFA (Prescription Drug User Fee Act): Plazo de 10 meses para la aprobación de un fármaco en EE.UU.
- Pipeline: se usa para referirse a los medicamentos, tratamientos o dispositivos médicos que están en desarrollo, aún no aprobados, pero que están siendo evaluados en estudios clínicos o fases de investigación.
- Market Exclusivity: Protección de mercado sin patente por aproximadamente 7 años.
- Composition of Matter: Patente sobre la estructura química de un medicamento.
- Method of Use: Patente sobre el mecanismo de acción del medicamento.